Топобиология
Этим термином охватываются биологические взаимодействия, определяемые пространственным расположением. Такие взаимодействия ярко проявляются в развивающемся зародыше. Их исследование дает ключ к разгадке происхождения иммунной системы
Джералд М. Эдельман
Одна из наиболее приятных особенностей занятия наукой заключается в том, что невозможно предсказать, куда приведет то или иное направление исследований. Интенсивное изучение чего-то одного может неожиданно осветить совсем другую проблему, долгое время остававшуюся загадкой. Такая неожиданная связь возникла недавно между двумя областями биологии, которым я посвятил большую часть своей научной деятельности. Первой областью было исследование структуры антител — молекул иммунной системы, которые распознают чужеродные агенты и приводят к их разрушению. Эта работа достигла своего апогея в конце 1960-х годов, когда, наконец, выяснилась сложная структура антител.
Затем, в начале 70-х годов, стало ясно, что антитела вместе с некоторыми другими молекулами иммунной системы составляют эволюционно родственную группу — так называемое сверхсемейство иммуноглобулинов. Хотя это было замечательным открытием, я, признаюсь, заинтересовался им гораздо меньше, чем если бы оно было сделано на несколько лет раньше. К тому времени меня уже занимала другая проблема: каким образом в развивающемся зародыше взаимодействуют клетки и в результате возникает новый организм. Эта новая работа привела к открытию молекул клеточной адгезии (CAM, от англ. cell-adhesion molecules), которые представляют собой белки, опосредующие взаимодействие клеток в зародыше.
Изучение CAM и родственных им молекул заложило фундамент молекулярной эмбриологии, связывающей форму и функцию эмбриональных тканей с эволюцией и генетикой. Данная статья посвящена в основном именно этим исследованиям, но в конце ее я вновь вернусь к предмету моей более ранней работы. По иронии судьбы открытие и исследование CAM позволили решить давнюю проблему эволюционного происхождения сверхсемейства иммуноглобулинов. Недавно выяснилось, что гены CAM и гены иммуноглобулинов так сходны по последовательности ДНК, что наверняка эволюционно родственны. Кроме того, CAM распространены во всем животном царстве, а адаптивная иммунная система есть только у позвоночных. Поэтому весьма вероятно, что молекулы иммунной системы возникли из генов системы межклеточной адгезии — замечательный пример того, как эволюция использует уже существующее для создания нового.
И антитела, и молекулы клеточной адгезии проявляют себя на поверхности клеток. Взаимодействие между поверхностями клеток может приводить к изменениям экспрессии генов, формы клеток, их движения и функционирования. Какой именно будет реакция на межклеточное взаимодействие, в значительной степени зависит от «истории» данных клеток, а именно от того, с какими клетками они взаимодействовали в прошлом. Более того, поскольку эти взаимодействия зависят от того, какими клетками окружена данная клетка, их реакции различаются в разных частях организма. Такие взаимодействия, определяемые пространственным расположением, происходят и в иммунной системе, но особую роль они играют в эмбриональном развитии. Судьба клетки, т.е. чем она станет в зрелом организме, самым существенным образом зависит от ее положения и ближайшего окружения в зародыше.
Эмбриологи давно понимали, что положение клетки в эмбрионе играет важную роль в определении ее судьбы. Но мне представлялось необходимым четко обозначить эту область исследований, чтобы яснее были ее задачи, и года два назад я предложил назвать изучение взаимодействий, происходящих на поверхности клеток, осуществляющих регуляцию их жизнедеятельности и зависящих от пространственного расположения, термином топобиология (от греч. topos — «место»).
Как стало ясно после открытия CAM, одним из основных факторов, определяющих положение клетки в эмбрионе (и тем самым форму и расположение тканей), являются молекулы клеточной адгезии. В последние годы было показано, что в адгезии клеток и сходных межклеточных взаимодействиях участвуют несколько семейств молекул. Помимо самих CAM, это молекулы адгезии к субстрату (SAM — от англ. substrate-adhesion molecules) и молекулы клеточных контактов (CJM — от англ. cell-junctional molecules). В то время как CAM всегда находятся на клеточной поверхности и опосредуют межклеточные взаимодействия, SAM секретируются клетками в межклеточную среду, где входят в состав сложного матрикса, к которому клетки могут прикрепляться. CJM участвуют в формировании сложных структур, соединяющих клетки в тканях, в частности так называемых плотных контактов, щелевых контактов и адгезионных контактов.
Все известные CAM, SAM и CJM представляют собой сложно устроенные белки; структура некоторых из них уже довольно хорошо изучена. Сейчас основное внимание уделяется тому, как функционируют эти белки в зародыше и взаимосвязаны ли функции различных молекул. Установлено, что почти все известные CAM взаимодействуют друг с другом по так называемому гомофильному механизму: CAM одной клетки связывается с CAM того же типа, расположенной на соседней клетке. Между разными CAM есть и различия: они обладают неодинаковой специфичностью связывания и по-разному зависят от ионов, в частности от ионов кальция.
В ходе эмбрионального развития многократно происходит превращение эпителия в мезенхиму и наоборот. Мезенхима представляет собой группу подвижных клеток, не связанных друг с другом или подвижных клеток, не организованных как-либо в пространстве. Эпителий, напротив, — это пласт клеток с высокой степенью организации, причем клетки своими основаниями обычно соединены с внеклеточным матриксом. Соединение эпителия с матриксом осуществляется SAM, а между собой эпителиальные клетки соединены специализированными контактными структурами, построенными из различных CJM. Поскольку превращение одной ткани в другую — это ключевой процесс эмбрионального развития, важно выяснить, какие из этих молекул ответственны за первичное превращение мезенхимы в эпителиальный пласт.
Недавно в моей лаборатории было показано, что на первых этапах формирования эпителия основную роль играют CAM, а формирование щелевых или адгезионных контактов определяется связыванием CAM между собой. В этих экспериментах осуществлялась трансфекция: в культивируемые клетки, не имеющие CAM, вводили ДНК, кодирующую эти молекулы. Были выбраны CAM двух типов — нервной ткани (N-CAM) и печени (L-CAM); эти белки названы так по тем тканям (N от «nerve», L от «liver»), в которых их впервые обнаружили, но теперь известно, что они представлены в эмбрионе гораздо шире.
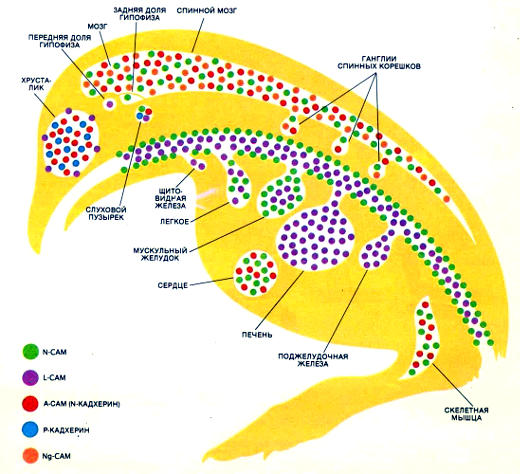
Распределение пяти известных молекул клеточной адгезии (CAM) в курином эмбрионе перед вылуплением. Распределение CAM, каждая из которых имеет свою специфичность связывания, позволяет предполагать, что они участвуют в формообразовании зародыша. Их локализация меняется со временем: на более ранних стадиях участки, занимаемые различными CAM, перекрывались и охватывали большую часть зародыша
До введения ДНК N-CAM клетки были от делены друг от друга и напоминали мезенхиму, а после трансфекции они объединились в пласт, напоминающий эпителиальный. Когда пласт сформировался, между клетками возникли щелевые и адгезионные контакты. Похоже, что в результате действия генов CAM происходит сборка предсуществующих CJM в контактные структуры, т.е. этот процесс зависит прежде всего от CAM. Более того, добавление фрагментов антител против L-CAM, блокирующих гомофильное связывание между этими молекулами, приводило к распаду пласта и заметному уменьшению числа контактов между клетками.
Эти результаты указывают на значение CAM в эмбриональном развитии. Как уже отмечалось, превращение эпителия в мезенхиму и обратно — один из важнейших процессов в эмбриональном развитии. Но это не единственный такой процесс. Так, например, весьма существенны некоторые точно организованные перемещения тканей и формирование новых границ между тканями. Роль CAM в этих пространственных перемещениях демонстрируется тем фактом, что CAM с разной специфичностью распределены по-разному. В развивающемся зародыше каждый из этих типов CAM имеет свою меняющуюся во времени картину распределения.
Прекрасный пример осуществления всех этих топобиологических процессов — формирование перьев у куриного эмбриона. Перья образуются в результате последовательных координированных процессов, включающих движение и размножение клеток, их запрограммированную гибель, прикрепление друг к другу и дифференцировку. На ранних этапах развитие перьев определяется взаимодействием двух типов эмбриональной ткани — мезодермы и эктодермы. Мезодерма дает начало большей части костей и мышц, а эктодерма — коже и нервной системе. Первым шагом к образованию перьев является индукция в специализированной эктодермальной ткани, называемой эпидермисом, особых структур — перьевых зачатков. Для их появления требуется обмен химическими сигналами между эктодермой и лежащей под ней мезодермой. Как выясняется, обмен сигналами зависит от CAM; это можно наблюдать, помещая кусочки кожи эмбриона в культуру ткани.
Недавно в моей лаборатории был проведен ряд экспериментов с целью нарушить связи между CAM и выяснить, как это сказывается на пространственных параметрах процесса образования перьевых зачатков. В нормально развивающемся эмбрионе индукция перьевых зачатков начинается вдоль средней линии тела, а затем распространяется в стороны, причем зачатки располагаются в гексагональном порядке. Такое распределение характерно и для плакод предшественников перьевых зачатков, из которых впоследствии сформируются структуры зрелого пера, и для сгущений дермы — подстилающих мезодермальных клеток. Сгущения дермы являются источником индукционного сигнала, необходимого для формирования плакод в вышележащем эпидермисе.
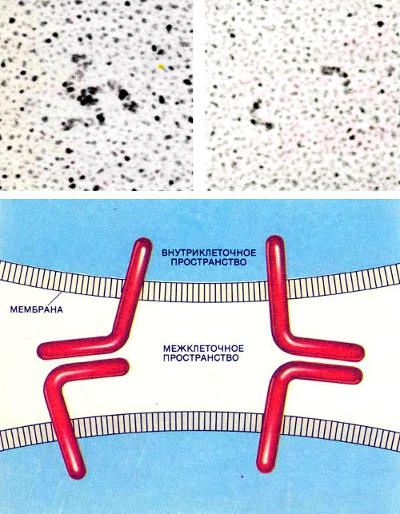
Клетки соединяются молекулами клеточной адгезии, связывающимися гомофильно. CAM одной клетки взаимодействует с такой же CAM на другой клетке. Изображения вверху получены с помощью электронного микроскопа после напыления CAM платиной. Слева: три молекулы клеточной адгезии из нервной ткани (N-CAM),соединенные теми участками, которые выступают из клеточной мембраны наружу. Справа: одиночные молекулы клеточной адгезии из печени (L-CAM). CAM представляют собой гибкие линейные молекулы. Внизу показаны два предполагаемых механизма связывания N-CAM
Клетки эпидермальных плакод связаны между собой L-CAM и не содержат N-CAM. Сгущения дермы, наоборот, содержат N-CAM, но не L-CAM. Мы предположили, что для правильного распределения перьевых зачатков необходимы сигналы не только от мезодермы к эпидермису, но и от эпидермиса к мезодерме, причем эта «сигнальная петля» как-то зависит от CAM. Поэтому мы добавили в культуру антитела к L-CAM. Эти антитела могли действовать только на межклеточные связи в эпидермисе, но не должны были влиять на сгущения дермы. Тем не менее после добавления антител распределение сгущений дермы также изменилось.
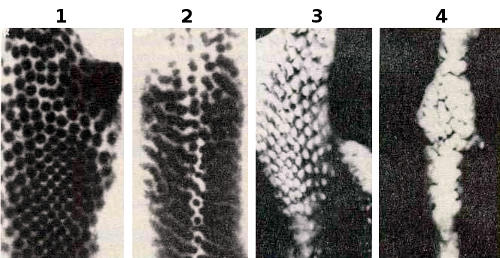
Участие молекул клеточной адгезии в формировании пера демонстрируется экспериментами, в которых нарушалось образование плакод. Обычно мезодермальные клетки образуют симметрично расположенные «узелки» под плакодами (1). Если ткань культивировать в присутствии антител против L-CAM, то образуются «полосы»»(2). Антитела мешают только связям с участием L-CAM (между клетками эпидермиса), но не N-CAM (между мезенхимными клетками). Тем не менее мезодерма распределяется иначе (4), чем в норме (3), что указывает на существование ««сигнальной петли» между этими двумя тканями
Результат этого эксперимента указывает, что нарушение связей между CAM в одном слое клеток влияет на «сигнальную петлю», от которой зависит нормальное распределение зачатков. При этом могут меняться как реакция эпидермальных клеток на сигналы от мезодермы, так и их собственные сигналы. В любом случае в итоге получается одно и то же: нарушается нормальный процесс пространственной организации. Интересно, что это длительный эффект. Даже через 10 дней после удаления антител из культуры характер развития перьев оставался нарушенным. Таким образом, правильная пространственная организация зависит от связи между клеточными ответами на индукционные сигналы и взаимодействиями, обеспечиваемыми CAM.
Эта связь сохраняет свое значение по мере развития перьев. Зрелое перо представляет собой сложную структуру, в которой от центральной оси (стержня, или стебля пера) отходят более мелкие лучевидные образования, называемые бородками I порядка. Бородки сцеплены друг с другом отходящими от них еще более короткими нитями — бородками II порядка с крючочками. Все эти образования построены из фибриллярного белка кератина. Кератин производится в клетках пера, которые к концу созревания пера умирают. Бородки I и II порядка формируются в так называемых перьевых стебельках из складок, носящих название бородковых валиков (см. рисунок ниже). Складки отделяются от стебельков, образуя цилиндрические структуры, которые и есть бородки I порядка, соединенные бородками II порядка.
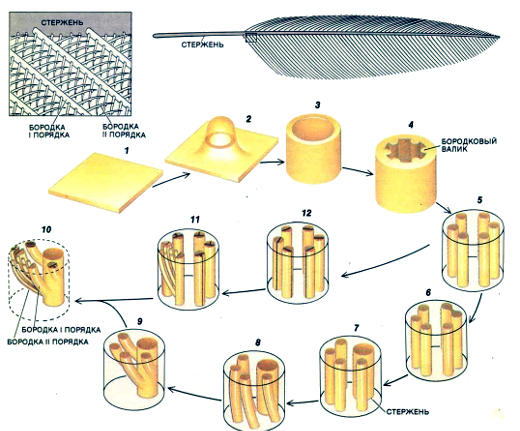
Перья у эмбриона птиц развиваются из так называемых плакод. Мезенхимные клетки мезодермального происхождения мигрируют под пласт эпидермиса (1) и образуют сгущения, из которых посылается сигнал, индуцирующий в эпидермисе образование плакоды. В этом месте пласт выпячивается, образуя почку (2), которая удлиняется, формируя эпидермальную трубку (3). В ней появляются эпителиальные валики, называемые бородковыми валиками (4), которые затем разделяются, так что получается ветвистая структура, характерная для зрелого пера (5-12)
Клетки бородковых валиков возникают из предшественников, которые исходно продуцируют как L-CAM, так и N-CAM. Однако по мере развития валиков происходит специализация, отделяющая валики от бороздок между ними. По мере созревания валиков в них исчезает N-CAM. Клетки же в бороздках в какой-то момент теряют L-CAM и, продуцируя только N-CAM, начинают размножаться, что приводит к образованию так называемых краевых пластинок, ограничивающих каждый валик. Вскоре после этого все клетки, продуцирующие L-CAM, начинают синтезировать кератин, а все клетки с N-CAM погибают. В результате границы между первыми и вторыми становятся границами новых структур — бородок I и II порядка.
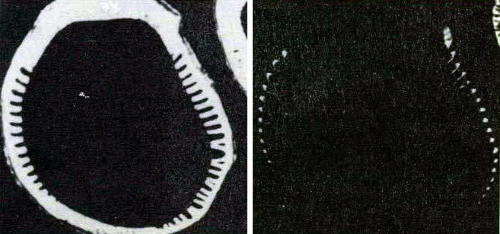
Чередование L-CAM и N-CAM в ходе развития бородковых валиков. Здесь представлены поперечные срезы развивающегося перьевого фолликула, окрашенные флуоресцентными антителами против L-CAM (слева) или же N-CAM (справа). L-CAM соединяют клетки валиков, а N-CAM-клетки, расположенные между валиками. Вскоре после этой стадии в клетках, продуцирующих L-CAM, образуется фибриллярный белок кератин, а клетки с N-CAM отмирают
Итак, присутствие специфических CAM в сочетании с дифференцировкой и запрограммированной гибелью клеток может привести к морфогенезу. Было бы ошибкой, однако, думать, что CAM — единственные морфорегуляторные молекулы. Недавно в моей лаборатории получены данные, показывающие, что SAM тоже могут участвовать в процессе формообразования в зародыше. Речь пойдет о клетках, из которых возникают ганглии спинных корешков — пучков нервов, расположенных в позвонках. Сами позвонки формируются из мезодермы, клетки которой образуют симметричные парные скопления, называемые сомитами. Каждый сомит соответствует одному позвонку. Сомиты дают начало также другим структурам: например, сгущения дермы птичьего пера образуются из мезенхимы, возникающей в сомитах. Ганглии спинных корешков формируются из эктодермальных клеток, мигрирующих в виде мезенхимы из участка эктодермы, называемого нервным гребнем.
Для того чтобы образование ганглиев происходило правильно, клетки нервного гребня должны проникать только в мезенхимную часть сомита (склеротом) с его передней стороны. Как направляется движение этих клеток? Эксперименты, проведенные ранее Ж.-П. Тьери из Национального центра научных исследований в Париже, показали, что клетки нервного гребня мигрируют по «путям», образуемым фибронектином (и рядом других молекул). Фибронектин относится к SAM. Мои коллеги и я обнаружили, что другой представитель SAM, цитотактин, также имеет характерное распределение в развивающемся эмбрионе. Цитотактин способен связываться с фибронектином и с еще одной SAM — протеогликаном, связывающим цитотактин (CTBP от англ. cytotactin-binding proteoglycan). Мы попытались выяснить, связан ли характер распределения клеток нервного гребня, мигрирующих в склеротом, с распределением трех различных SAM в сомитах.
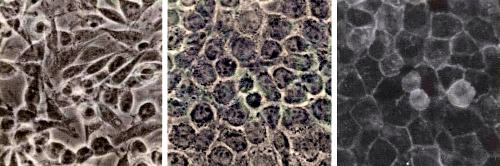
Изменение организации групп клеток под влиянием CAM видно на этих микрофотографиях, полученных в лаборатории автора. Культивируемые клетки, не имеющие гена L-CAM, формируют рыхлые скопления, похожие на мезенхиму эмбриона (слева). Если в такие клетки ввести ген L-CAM и активировать его, их пространственная организация становится более упорядоченной, напоминающей структуру эпителия (в середине). При этом на клеточной поверхности с помощью флуоресцентной метки выявляются L-CAM (светлые участки на фотографии справа)
На ранних стадиях эмбриогенеза цитотактин, фибронектин и CTBP в каждом сомите распределены равномерно. Затем распределение SAM изменяется: фибронектин остается расположенным более или менее равномерно, цитотактин концентрируется в передней части каждого сомита, а СТВР — в задней части (последнее происходит несколько позднее). Такое чередование SAM возникает как раз в тот момент, когда мигрирующие клетки проникают в склеротом, причем все эти молекулы синтезируются не попавшими в сомит клетками нервного гребня, а клетками самого сомита.
Мы попытались определить, как влияют различные SAM на форму клеток и их движение. Опыты в культуре ткани показали, что цитотактин и CTBP вызывают округление клеток нервного гребня и подавляют их движение. Более того, такие округленные клетки не мигрируют в ткань, содержащую эти SAM. Если же субстрат был покрыт только фибронектином, то на нем клетки нервного гребня имели более распластанную форму и легко перемещались. На смеси фибронектина с любой из двух других SAM наблюдалась промежуточная картина. Хотя в деталях это явление еще не ясно, можно сделать вывод, что разные сочетания связывающихся друг с другом SAM по-разному влияют на поведение клеток и их движение в эмбрионе.
Важно, что такие процессы с участием SAM пространственно согласованы с продуцированием CAM: мигрирующие клетки нервного гребня в процессе движения теряют N-CAM, но, когда они начинают образовывать в сомите ганглии спинных корешков, на их поверхности вновь появляются эти молекулы. (N-CAM есть на поверхности практически всех нервных клеток в зрелом дифференцированном состоянии.) Очевидно, CAM и SAM в ходе развития регулируются координированно; оба типа молекул могут влиять на расположение тканей. Как отмечалось выше, прежде чем возникнут клеточные контакты, образованные CJM, клетки должны связаться друг с другом с помощью CAM. По-видимому, в ходе развития организма идет постоянная «игра» взаимных влияний между тремя типами морфорегуляторных молекул.
Хотя взаимодействия морфорегуляторных молекул и сложны, их недостаточно для объяснения эмбрионального развития. Для дифференцировки и превращения эмбриональных тканей в зрелые необходим синтез тканеспецифических белков: в печеночных клетках нужны одни белки, в мышечных клетках — другие и т.д. Такие белки и молекулы клеточной адгезии кодируются совершенно разными генами. Однако гены этих двух типов действуют координированно. Для объяснения связи между ними я предложил так называемую морфорегуляторную гипотезу.
Согласно этой гипотезе, клетки управляются механохимическими циклами экспрессии генов CAM и окружающими SAM. В качестве примера можно привести изменение формы и движения клеток нервного гребня в результате их прикрепления к различным SAM. Экспрессия генов CAM и SAM определяет форму клеток и их реакцию на внешние сигналы, регулируя образование групп клеток, обменивающихся между собой сигналами. Таким образом экспрессия генов CAM и SAM влияет на экспрессию других генов, в том числе и генов, кодирующих тканеспецифические белки. По топобиологической концепции механохимические силы, создающие группы клеток, регулируются взаимодействием клеточных поверхностей. Образование этих групп сопровождается изменением сигналов, подаваемых клетками, и их уровня дифференцировки. Такое влияние на клетки со стороны CAM и SAM должно играть важнейшую роль в формообразовании животного организма и в пространственной организации тканей.
Исходя из морфорегуляторной гипотезы, мои коллеги и я сконцентрировали свое внимание на генах, кодирующих морфорегуляторные молекулы, в частности CAM. Мы с Б. Каннингэмом выяснили структуру генов N-CAM и L-CAM, установив нуклеотидную последовательность ДНК, кодирующей эти белки. Оказалось, что N-CAM и L-CAM определяются каждый одним геном, причем данные два гена существенно различаются. Скорее всего, N-CAM и L-CAM не родственны друг другу в эволюционном смысле.
Различия между генами N-CAM и L-CAM обусловлены отчасти тем, как происходит процессинг транскрибируемой с них РНК. Почти все гены млекопитающих содержат помимо кодирующих последовательностей ДНК, называемых экзонами, некодирующие участки — интроны. После транскрипции гена происходит сплайсинг образовавшейся РНК: некодирующие участки удаляются, а кодирующие соединяются, в результате чего получается матричная РНК (мРНК), по которой затем синтезируется белок. Если возможны альтернативные варианты сплайсинга, то могут образовываться разные белки. Именно так происходит образование N-CAM: 19 (или даже больше) экзонов соединяются несколькими разными способами, так что получаются белки, различающиеся по тому участку молекулы, которым она присоединяется к клеточной мембране. Изменения этого участка могут сказываться на прочности связывания N-CAM друг с другом и с цитоскелетом — внутренним скелетом клетки. А для L-CAM, хотя его ген тоже состоит из множества экзонов, альтернативный сплайсинг не известен.
Следует отметить, что альтернативный сплайсинг, наблюдаемый при экспрессии гена N-CAM, не влияет на специфичность гомофильного связывания: взаимодействие молекул этого белка друг с другом не зависит от того, как происходил сплайсинг РНК. Альтернативный сплайсинг приводит только к изменению общей прочности связывания между клетками: меняются число и расположение молекул CAM, что связано с изменением характера прикрепления их к клеточной мембране. Этот факт согласуется с предположением о том, что существует всего несколько десятков CAM с разной специфичностью связывания, но регуляция их активности на клеточной поверхности различными способами может приводить к самым разнообразным изменениям характера и силы связывания.
Нам удалось выявить некоторые другие члены этого небольшого семейства молекул. Вскоре после того, как Каннингэм и я сообщили о своих результатах, рядом исследований было обнаружено сходство между N-CAM и еще одним белком, присутствующим в нервной ткани. Сейчас предполагается, что этот белок — гликопротеин, ассоциированный с миелином (MAG — от англ. myelin-associated glycoprotein), — тоже является молекулой клеточной адгезии. М. Такеити и его коллеги из Университета в Киото показали, что другие CAM, названные кадхеринами, сходны с L-CAM по нуклеотидной последовательности, но имеют совсем другое распределение в эмбриональных тканях.
Все эти данные о генетической структуре CAM очень интересны, но еще более замечательным представляется открытие структурной гомологии между N-CAM и молекулами антител. Когда в 1969 г. мы с коллегами завершили анализ аминокислотной последовательности молекулы антитела, стали очевидны многие структурные, генетические и эволюционные закономерности.
На основе этих закономерностей в 1969 г. была сформулирована «доменная» гипотеза, согласно которой иммуноглобулины состоят из двух типов структурных и функциональных субъединиц длиной около 100 аминокислотных остатков: вариабельных (V)доменов, различающихся у разных молекул одного функционального класса, и константных (C) доменов, различающихся у молекул разных классов, но одинаковых в пределах класса. Молекула антитела, имеющая характерную Т-образную форму, образована двумя «легкими» полипептидными цепями, содержащими по одному вариабельному и одному константному домену, и двумя «тяжелыми» цепями, в каждой из которых один вариабельный домен и три константных. V-участки ответственны за связывание с антигеном, а C-участки выполняют различные «эффекторные» функции (в частности, способствуют поглощению связавшегося с антителом чужеродного белкового антигена клетками иммунной системы, называемыми макрофагами). Все домены, как V, так и C, имеют определенную гомологию в аминокислотной последовательности и поэтому предполагалось, что в ходе эволюции они возникли в результате повторной дупликации некоего гена-предшественника, кодирующего участок, не превышающий по размеру один домен.
Доменная гипотеза полностью подтвердилась. Обнаружились новые члены постулированной ею группы родственных молекул, называемой суперсемейством иммуноглобулинов: рецепторы факторов роста и антигены тканевой совместимости, определяющие некоторые важные взаимодействия между клетками иммунной системы. Но вопрос о том, как эта разнородная группа возникла, оставался открытым.
Тот факт, что N-CAM гомологична членам суперсемейства иммуноглобулинов позволяет дать вероятный ответ на него. Я предположил, что вся адаптивная иммунная система, характеризующаяся наличием суперсемейства иммуноглобулинов, возникла из более древней системы клеточной адгезии. Эта гипотеза основывается на том, что адаптивная иммунная система есть лишь у позвоночных, т.е. сложилась на поздних этапах эволюции, а система молекул клеточной адгезии распространена, судя по всему, гораздо шире.
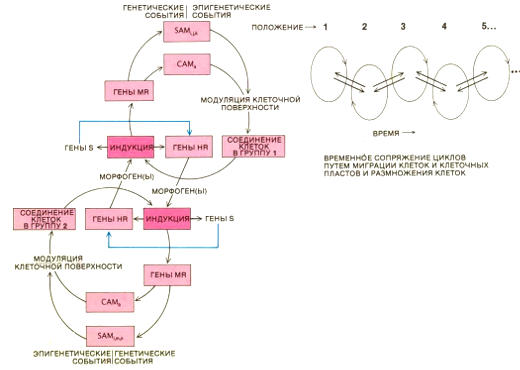
Морфорегуляторная гипотеза призвана объяснить, как молекулы клеточной адгезии (CAM) и адгезии к субстрату (SAM) обеспечивают образование групп клеток и взаимодействуют с ними, определяя форму тела животного. В цикле CAM (слева) группы клеток, связанных CAM, производят молекулы, называемые морфогенами. Морфогены вызывают в клетках, соединенных разными CAM, изменения активности морфорегуляторных генов (МR),кодирующих CAM и SAM. Морфогены влияют также на гены (НА), кодирующие тканеспецифические белки. В некоторых клетках такие гены регулируются селекторными (S) генами. После, взаимодействуя, группы клеток изменяют свое окружение и начинаются новые циклы CAM (справа) , которые влияют друг на друга (двойные стрелки)
Некоторые новые данные подтверждают мою точку зрения. Т. Кауфман и М. Сигер из Индианского университета обнаружили в генном комплексе antennapedia плодовой мушки Drosophila melanogaster последовательность ДНК, гомологичную приблизительно двум с половиной доменам гена N-CAM; она кодирует белок под названием амальгам. Затем К. Гудмэн и его коллеги из Калифорнийского университета в Беркли показали, что последовательность обнаруженного в нервных клетках Drosophila фасциклина 11, который, как предполагается, является молекулой клеточной адгезии, также гомологична N-CAM. Поскольку у насекомых есть молекулы, сходные с N-CAM, а иммунная система, основанная на антителах, свойственна только позвоночным, то вполне вероятно, что гены молекул адаптивной иммунной системы возникли из генов CAM, имевшихся у общего предка насекомых и позвоночных.
Ряд фактов помогает составить схему эволюции молекул клеточной адгезиии возникших из них белков, согласующуюся с доменной гипотезой и являющуюся ее продолжением. В отличие от молекул клеточной адгезии каждый иммуноглобулин кодируется многими генами вариабельных и константных участков, возникшими в ходе эволюции в результате дупликации исходного предшественника. Семейства дуплицированных генов у разных видов позвоночных гомологичны. Но независимые мутации, накапливающиеся в разных генах такого семейства, должны разрушать гомологию между видами, если только нет специального механизма, благодаря которому она сохраняется. Что же это за механизм?
В 1969 г. я и мой коллега Дж. Гэлли предположили, что семейства генов могут эволюционировать параллельно у разных видов, если гены участвовали в процессе, названном нами «демократичной генной конверсией». Описание деталей этого гипотетического процесса выходит за рамки данной статьи, но суть его заключается в том, что гены одного семейства рекомбинируют между собой таким образом, что становится возможной коэволюция. Более того, семейства могут служить своего рода ловушкой для мутаций, благодаря чему полезные мутации распространяются среди членов семейства. Поскольку мутации, полезные для адаптивной иммунной системы у одного вида, скорее всего ценны и для другого вида, такой процесс в совокупности с давлением отбора может обеспечить сохранение гомологии в семействах иммуноглобулиновых генов. Идея эта приложима к эволюции не только антител, но и всех мультигенных семейств.
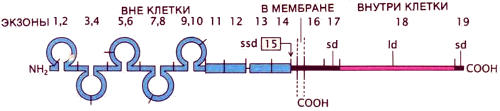
Структура N-CAM была выяснена в результате химического анализа белка и определения нуклеотидной последовательности его гена. В этом гене кодирующие последовательности, называемые экзонами (здесь показано 19 экзонов, но сейчас их известно больше), разделены некодирующими участками и возможен альтернативный сплайсинг РНК. Поэтому существует несколько вариантов N-CAM. Во всех известных вариантах белка полипептидная цепь образует пять петель, скрепленных дисульфидными связями (слева). На этом рисунке изображены три варианта:ssd кончается на экзоне 15 и не имеет трансмембранного участка, sd не содержит экзона 15, но включает экзоны 17 и 19, в ld также нет экзона 15, но есть экзон 18
Функциональная связь между молекулами клеточной адгезии и антителами демонстрируется тем, что разнообразные лимфоциты, относящиеся к числу важных эффекторных клеток иммунной системы, для выполнения своих функций нуждаются в механизме адгезии. Т. Спрингер из Медицинской школы Гарвардского университета недавно во многих типах клеток обнаружил молекулы, названные I-CAM, которые гомологичны N-CAM. Оказалось, что I-CAM связывается с молекулой, известной под названием LFA-I, которая присутствует на лимфоцитах. LFA- I напоминает молекулы клеточной поверхности, называемые интегринами, которые служат рецепторами SАМ.
Если всю эту информацию объединить в общую схему, то получается прекрасный пример того, как в ходе эволюции уже существующие структуры используются для новых функций. Вначале имелся фрагмент ДНК, кодирующий примерно половину домена N-CAM. Анализ структуры гена N-CAM показал, что такой предшественник дуплицировался у предков насекомых и позвоночных и в результате возникли гены типа гена N-CAM. Вследствие перекомбинации экзонов в геноме образовались последовательности ДНК, кодирующие SAM, такие как фибронектин. Ген адгезионной молекулы типа N-CAM затем дуплицировался, дав начало другим родственным CAM, в том числе действующим в центральной нервной системе, например МАО.
Функции всех таких молекул были связаны с морфогенезом. Но у каких-то древних позвоночных (или их непосредственных предков) один из генов этого семейства переключился на другую функцию. В результате дупликации участка ДНК, кодирующего CAM, возникли вариабельные и константные участки иммуноглобулиновых генов, рецепторы одного из типов лимфоцитов и антигены тканевой совместимости. Впоследствии гены V-участков многократно дуплицировались и образовались семейства генов, которые оставались похожими друг на друга в результате демократичной генной конверсии. Сходные конверсионные события происходили и в семействе генов тканевой совместимости. Возникли специальные CAM, такие как I-CAM, служащие местом прикрепления для LFА-I независимо от возникшего рецептора, располагающегося на поверхности лимфоцитов.
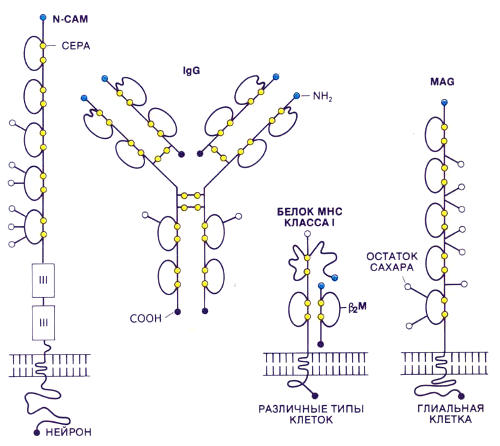
Сверхсемейство иммуноглобулинов, включающее и молекулы клеточной адгезии, объединяет белки, различающиеся по структуре и функциям. Каждый из них содержит несколько доменов. Антитела класса IgG циркулируют в жидкостях тела и связываются с чужеродными веществами. Белки главного комплекса тканевой совместимости (МНС) класса I, имеющиеся почти во всех клетках животного организма, соединяются с определенным образом измененными антигенами, что необходимо для представления антигенов Т-лимфоцитам. Короткая цепь белка МНС класса I — это один домен, так называемый бета2-микроглобулин. В мембране глиальных клеток нервной ткани присутствует гликопротеин, ассоциированный с миелином (MAG), который тоже, повидимому, участвует в клеточной адгезии. Глиальные клетки (и MAG) играют роль в образовании миелиновой оболочки отростков некоторых нейронов
Итак, основные функции адаптивной иммунной системы возникли из более ранней системы клеточной адгезии, функция которой заключалась в том, чтобы регулировать движение клеток и пространственную организацию тканей, определяя тем самым строение животного. Хотя лимфоциты не участвуют в формообразовании, их функции основываются на регулируемых взаимодействиях между клетками. Эта регуляция в свою очередь зависит от специфических механизмов связывания, ведущих свое происхождение от древней системы клеточной адгезии. Во всех участках связывания иммуноглобулинов, а возможно и CAM, белковые молекулы имеют характерную структуру, называемую бета-складчатым слоем; в иммуноглобулиновом домене два таких слоя образуют как бы сандвич. Быть может, бета-складчатый слой это остатки древнего «языка» связывания и клеточной регуляции, доставшиеся адаптивной иммунной системе в наследство от ее предшественников типа молекул клеточной адгезии.
Часто иммунную систему отождествляют с реакцией между антигеном и антителом, которая может происходить и «в пробирке» — в жидкой среде и независимо от пространственной ориентации. Не следует, однако, забывать, что иммунная система состоит не только из жидких тканей (таких, как кровь), но и из плотных (таких, как лимфатические узлы). Даже среди циркулирующих в крови лимфоцитов есть популяции, имеющие сродство к определенным плотным тканям. Хотя иммунные реакции одиночных клеток могут происходить и «в пробирке», весьма вероятно, что пространственное расположение играет в иммунном ответе столь же большую роль, как и в морфогенезе. Недаром анализ морфорегуляторных молекул и иммуноглобулинов показывает, что эти две системы тесно связаны друг с другом как генетически, так и эволюционно.
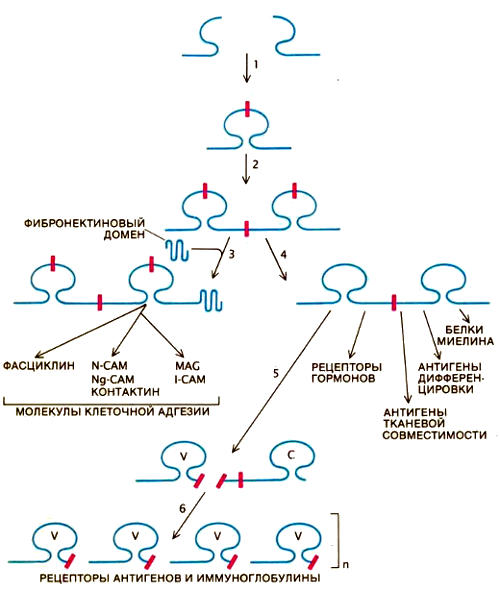
Схема,показывающая, как адаптивная иммунная система развилась из древней системы молекул клеточной адгезии. Экзоны, кодирующие два «полудомена», соединились и образовали ген одного домена — функциональной единицы белка (1). В результате дупликации этого гена возник ген мультидоменного белка — древней N-CAM (2). Перекомбинация экзонов привела к объединению доменов типа фибронектина с доменами типа N-CAM (3). Вследствие дупликации генов и дивергенции появилось множество различных САМ. Другие гены утратили интроны (некодирующие последовательности ДНК) внутри доменов, но не между ними (4). В этой группе генов дивергенция привела к возникновению других членов суперсемейства иммуноглобулинов . Встраивание нового генетического элемента (возможно, вирусного происхождения) обусловило разнообразие белков в различных лимфоцитах (5). Наряду с этими изменениями увеличивалось число вариабельных участков (V), что обеспечило создание огромного множества различных антител (иммуноглобулинов) и рецепторов антигенов в течение жизни организма(6)
Пожалуй, в заключение не будет лишним сказать несколько слов о путях развития науки. Вся идеология, связующая молекулы иммунной системы и молекулы клеточной адгезии, была бы невозможна в пределах узкоспециализированных исследований в той или иной области. Для того чтобы решить проблему, поставленную одним исследованием — о происхождении иммуноглобулинов, потребовалась длительная кропотливая работа в, казалось бы, совсем другой области — изучение клеточной адгезии. Эта идеология была бы гораздо беднее, если бы возникла в рамках какой-то одной области — эмбриологии или иммунологии. Только рассматривая биологию с широких эволюционных, генетических и эмбриологических позиций и в то же время проводя специализированные исследования, удается соединить то, что на первый взгляд кажется несвязанным, в непротиворечивое целое, доставляющее наслаждение самому исследователю.
1989 г.