Газообразное состояние вещества
Вещества в газообразном состоянии не обладают определенной формой и объемом, характеризуются малой плотностью, малой вязкостью и способны целиком заполнять любое пространство.
Изучение свойств газов привело к кинетической теории газов. Согласно кинетической теории газ представляют как совокупность атомов или молекул, находящихся в движении. Атомы или молекулы движутся по прямым линиям, сталкиваются друг с другом и со стенками сосуда, меняя свое направление по закону столкновения упругих тел, — угол падения равен углу отражения. Молекулы движутся с различными скоростями (закон распределения скоростей Максвелла). Наибольшими средними скоростями обладают молекулы самых легких газов. Для водорода, например, средняя скорость при 0°C 1698 см/сек. Скорости молекул других простых и сложных газов составляют приблизительно 400—300 см/сек. Удары движущихся молекул о стенки сосуда обусловливают давление газов.
1. Идеальные газы
Если допустить, что между молекулами (атомами) газа нет притяжения и что можно пренебречь объемом самих молекул (атомов), то между объемом (V), занимаемым газом, температурой (T) и давлением (P) легко выводится следующее соотношение:
P · V = nRT,
где R — универсальная газовая постоянная, обозначаемая начальной буквой фамилии французского ученого Реньо, а n — число киломолей газа, т. е. отношение массы газа в кг к его молекулярной массе. Для R в углеродной шкале принято значение (8314,31 ± 0,31) дж (кмоль · град).
Вышеуказанное уравнение называется уравнением идеальных газов Клапейрона — Менделеева.
2. Реальные газы
Говоря о реальных газах, нужно принимать во внимание притяжение между отдельными молекулами (атомами). Это притяжение обратно пропорционально квадрату объема, занимаемого газом. По предложению Ван-дер-Ваальса оно обозначается буквой a. Притяжение между молекулами (атомами) сжимает газы, следовательно, равноценно увеличению давления на газ, именно, на величину a/V2. Таким образом, давление реального газа в объеме V должно быть равно P + a/V2 , где величина a зависит от природы газа.
Следует также учесть и то, что молекулы (атомы) реальных газов сами занимают некоторый объем, так что в действительности их движение происходит не в объеме V, а в объеме V—b. Приняв это во внимание, уравнение реальных газов можно написать в таком виде:
(P + a/V2)(V—b) = nRT.
Для точных расчетов необходимо при вычислении применять это уравнение, называемое уравнением Ван-дер-Ваальса.| Таблица 1. Значения величин a и b для различных газов | |||
| Вещество | Формула | a | b |
| Водород | H2 | 0,00049 | 0,001188 |
| Азот | N2 | 0,00277 | 0,001763 |
| Кислород | O2 | 0,00265 | 0,001392 |
| Аргон | Ar | 0,00259 | 0,001348 |
| Хлор | Cl2 | 0,01063 | 0,002050 |
| Окись азота | NO | 0,00267 | 0,001245 |
| Окись углерода | CO | 0,0285 | 0,001723 |
| Двуокись углерода | CO2 | 0,00683 | 0,001813 |
Межмолекулярное взаимодействие. Силы взаимодействия между молекулами или атомами называются ван-дер-ваальсовскими. Они проявляются во всех агрегатных состояниях веществ. Чем ближе расстояние между молекулами, тем больше ван-дер-ваальсовское взаимодействие. Так как среднее расстояние между молекулами для газообразных веществ наибольшее, то силы ван-дер-ваальса для них относительно малы. Чем большее сжатие испытывает газ, тем больше ван-дер-ваальсовские силы: при больших давлениях газы отступают от законов идеальных газов.
Естественно, что в жидкостях межмолекулярные взаимодействия более значительны, а в твердых телах — максимальны.
Приведение реального газа к состоянию идеального. Если известны поправочные коэффициенты уравнения Ван-дер-Ваальса а и b, то можно вычислить (PV)∞, т.е. при бесконечном разбавлении, когда коэффициентами а и b, вследствие их незначительной величины, можно пренебречь, реальные газы строго подчиняются законам идеальных газов. Этот прием называется приведением газа к состоянию идеального газа.
Чтобы найти приведенную плотность реального газа (D), нужно величину ее разделить на произведение (1 + а) (1 — b):
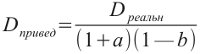
В табл. 2 сравнены приведенные молекулярные объемы с молекулярными объемами реальных газов.
Из табл. 2 видно, что приведенный молекулярный объем реальных газов равен 22,4135 м3/кмоль, т.е. объем киломоля реальных газов при нормальных условиях, приведенный к состоянию идеального газа, составляет 22,4135 м3/кмоль.
| Таблица 2. Сравнение молекулярных объемов реальных газов с приведенными молекулярными объемами | ||||
| Название | Формула | Молекулярная масса | Молекулярный объем реального газа, м3/кмоль | Приведенный молекулярный объем, м3/кмоль |
| Кислород | O2 | 31,9988 | 22,394 | 22,414 |
| Водород | H2 | 2,01594 | 22,426 | 22,413 |
| Азот | N2 | 28,0134 | 22,400 | 22,413 |
3. Переход газа в состояние жидкости
Уравнение идеальных газов устанавливает, что соотношение между объемом (V), давлением (P), числом молекул (n) и абсолютной температурой для всех газов одинаково и не зависит от их природы. Мы видели, что на практике это не так. Каждый реальный газ имеет свою индивидуальность, которая определяется различными значениями величин а и b.
Далее, если бы все газы подчинялись уравнению Клапейрона, то никаким давлением и никаким понижением температуры их нельзя было бы превратить в жидкость. Практика же показала, что все газы при определенных для каждого газа температуре и давлении превращаются в жидкость. Температура и давление, при которых данный газ превращается в жидкость, зависят от значений для этого газа величин a и b уравнения Ван-дер-Ваальса.
На рисунке изображены изотермы P, V для моля, т. е. зависимость изменения объема грамм-молекулы двуокиси углерода (CO2) от давления при разных температурах, вычисленные по формуле Ван-дер-Ваальса.
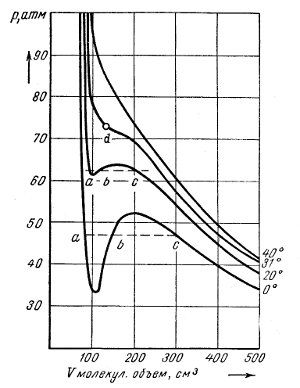
Изотерма при 0°C показывает, что с возрастанием давления объем сперва уменьшается, но до некоторого максимума давления; затем объем продолжает уменьшаться, но давление падает до некоторого минимума, так что для каждого данного давления мы имеем два объема. На практике состояния, выражаемые изломами кривой, неустойчивы — здесь газ превращается в жидкость.
Чтобы лучше уяснить себе, что происходит, представим, что грамм-молекула СО2 заключена в цилиндр, закрытый поршнем. Наложением грузов на поршень мы можем увеличивать или уменьшать давление. Опыт ведется при 0°C. Увеличивая давление на поршень с 35 атм приблизительно до 47 атм, мы наблюдаем уменьшение объема газа с 0,500 м3 приблизительно до 0,300 м3. При этом объем газа изменяется согласно закону Бойля — Мариотта. Увеличив давление на бесконечно малую величину, мы увидим, что в цилиндре, кроме газа, появилась жидкость.
При дальнейшем движении поршня новые количества газа переходят в жидкое состояние, нагрузка же на поршень, т. е. давление, остается неизменным.
На рисунке это выражается пунктирной линией abc. По этой линии справа налево каждому движению поршня соответствует уменьшение объема газа и увеличение количества жидкости. В точке d газ исчез — он целиком превратился в жидкость. При дальнейшем увеличении давления на поршень объем жидкости, как показывает изотерма, меняется очень мало.
Итак, при температуре 0°C и давлении ~48 атм мы превращаем газ CO2 в систему, состоящую из газа и жидкости.
По рисунку мы видим, что при 20°C, чтобы превратить газ CO2 в жидкость, нужно поднять давление до 62 атм, причем участок кривой и пунктирная линия abc станут значительно меньше. При 31°C этот участок сжался до точки. Это значит, что при температуре 31°C и давлении в 73 атм нельзя сжать газ CO2 в жидкость, или различие между газом и жидкостью при этих условиях исчезает.
При температуре 40°C и выше газ также никаким давлением нельзя сжать в жидкость.
Температура, при которой газ никаким давлением нельзя сжать в жидкость, называется критической температурой. Давление, при котором кривая ас превращается в точку, называют критическим давлением. Критическая температура для каждого вещества имеет свое особое значение. Газ при температуре выше критической условились называть газом, при температуре ниже критической — паром. Критическая температура есть мера стремления вещества принимать газообразное или жидкое состояние (табл. 3).
Для некоторых веществ, например гелия, водорода, кислорода и др. она очень низка. Поэтому прежде полагали, что эти вещества вообще не могут существовать в состоянии жидкости и называли их перманентными газами.
В настоящее время нет таких газов, которые невозможно было бы превратить в жидкое состояние.
| Таблица 3. Критическая температура, критическое давление и критическая плотность некоторых веществ | ||||
| Название веществ | Формула | Критическая температура, °С | Критическое давление, атм | Критическая плотность |
| Гелий | He | —267,9 | 2,26 | 0,06 |
| Водород | H2 | —239,9 | 12,8 | 0,031 |
| Неон | Ne | —228,7 | 26,9 | 0,4 |
| Азот | N2 | —147,0 | 33,5 | 0,311 |
| Аргон | Ar | —122,0 | 48 | 0,53 |
| Кислород | O2 | —118,4 | 50,1 | 0,430 |
| Окись азота | NO | —93 | 64 | 0,52 |
| Криптон | Kr | —63,8 | 54,3 | 0,78 |
| Хлористый водород | HCl | +51,4 | 81,5 | 0,42 |
| Аммиак | NH3 | +132,3 | 111,3 | 0,24 |
| Хлор | Cl2 | +144 | 76,1 | 0,573 |
| Двуокись серы | SO2 | +157,2 | 77,7 | 0,52 |
| Бром | Br2 | +311 | 102 | — |
| Уксусная кислота | C2H4O2 | +322 | 57 | 0,171 |
| Вода | H2O | +374,2 | 218,3 | 0,056 |
| Иод | I2 | +553 | — | — |
| Ртуть | Hg | >1550 | >200 | 4—5 |
