Сокращение мышечных волокон
Мышечные клетки имеют разнообразную структурную организацию и функциональные свойства. Принято различать поперечнополосатые, сердечные и гладкие мышечные клетки, но необходимо подчеркнуть, что в каждой из указанных групп имеется также большое разнообразие. Оно является выражением приспособительной специализации для выполнения разных функциональных задач, разных движений.
По скорости сокращения мышцы могут различаться в десятки тысяч раз. Самая высокая из них наблюдается у так называемых асинхронных летательных мышц некоторых насекомых. Так, у комара-дергуна частота взмахов крыльев может достигать 2200 в 1 с, так что полный цикл сокращения — расслабления должен совершаться не более чем за 0,45 мс. У этих мышц нет соответствия (синхронности) между нервными импульсами, являющимися естественной причиной сокращения, и мышечными сокращениями, на один импульс их может приходиться от 5 до 20. Это объясняется механическими резонирующими свойствами асинхронных мышц.
Среди синхронных мышц, у которых число сокращений соответствует числу импульсов, самыми быстрыми являются наружные глазные мышцы млекопитающих. Длительность их сокращения составляет 40—20 мс; для слитного сокращения этой мышцы необходима частота раздражения не менее 350 импульсов в 1 с. Длительность одиночной волны сокращения большинства поперечнополосатых мышц позвоночных и насекомых колеблется в пределах от 60 до 200 мс. Многие мышцы беспозвоночных, исчерченные и неисчерченные, сокращаются с такой же скоростью, что и скелетные мышцы позвоночных, но время расслабления у них, как правило, гораздо больше. Сокращения гладких мышц позвоночных могут длиться иногда секундами, а беспозвоночных — даже минутами. Наибольшей величиной укорочения (90% от исходной длины) обладают некоторые мышцы беспозвоночных. Скелетные мышцы позвоночных сокращаются на 20—70%', а двигательные мышцы насекомых всего лишь на 2—5% от исходной длины.
По величине развиваемого напряжения мышцы также значительно варьируют. Так, максимальное напряжение у скелетной мышцы лягушки равно 3 кг/см2, у скелетной мышцы человека — 4 кг/см2, а у гладкой части аддуктора двустворчатого моллюска — 8 кг/см2.
Независимо от функциональных особенностей все мышечные клетки содержат большое количество специальных сократительных белков. Они составляют от 60 до 80% от общего содержания белка в мышце. Главными сократительными белками мышечных клеток являются фибриллярные белки миозин, актин, тропомиозин. Миозин и актин способны образовывать прочное комплексное соединение актомиозин. Свойства и количество указанных белков варьируют в различных мышечных клетках, коррелируя с их функциональными свойствами. От общего количества сократительных белков миозин составляет 55—60%, актин — 20—25% и тропомиозин — 4—30%. В поперечнополосатых мышцах тропомиозина содержится незначительное количество (3—8%), в гладких — гораздо больше (до 30%). В запирательных мышцах моллюсков, способных развивать большое напряжение в течение длительного времени (запирательный тонус), содержится около 30% сократительного белка парамиозина, по своим свойствам близкого к тропомиозину позвоночных.
Вместе с указанными главными сократительными белками обнаруживаются в незначительных количествах так называемые «минорные белки» — тропонин, α-актин, β-актин, Δ-белок, которые, по-видимому, являются регуляторными белками.
Сократительные белки в мышечных клетках организованы в протофибриллы, а в некоторых из них и в более сложные структуры — миофибриллы. В поперечнополосатых мышечных волокнах миофибриллы имеют поперечную исчерченность вследствие регулярного чередования в них протофибрилл разного сорта — тонких и толстых. В большинстве гладких мышц имеются толстые и тонкие протофибриллы, но у них отсутствует правильное, регулярное расположение, а поэтому нет и поперечной исчерченности. У моллюсков и кольчатых червей есть мышцы со спиральным расположением протофибрилл.
Поперечнополосатые мышечные волокна имеются не только в двигательном аппарате позвоночных, но также почти у всех типов беспозвоночных (кишечнополостные, черви, моллюски, членистоногие). Однако по строению и функциональным свойствам они значительно различаются. Даже среди поперечнополосатых мышечных волокон позвоночных одни приспособлены для быстрых фазных движений и характеризуются высокой АТФ-азной активностью, другие же осуществляют длительные тонические напряжения, они малоутомляемы и имеют высокоактивные окислительные ферменты.
Лучше всего состав и строение сократительной системы изучены в поперечнополосатом мышечном волокне позвоночных, а среди них — в скелетном волокне лягушки. Поэтому мы и рассмотрим его более подробно.
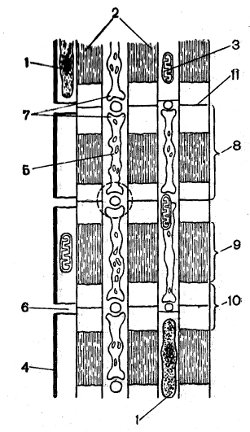
Рис. 45. Схема строения поперечнополосатого мышечного волокна лягушки: 1 — ядро; 2 — миофибриллы; 3 —. саркосома; 4 — сарколемма; 5 — саркоплазматический ретикулум; 6 — T-система; 7 — терминальные кристы; 8 — саркомер; 9 — А-диск, 10 — I-диск; 11— мембрана. Пунктиром обведена триада
Диаметр волокна варьирует от 10 до 150 мкм, длина может достигать нескольких сантиметров. Снаружи волокно покрыто тонкой (~60 нм) соединительнотканной оболочкой — сарколеммой, тесно прилегающей к плазматической мембране волокна. Сократительные миофибриллы тянутся вдоль всего волокна от одного его конца до другого. Помимо миофибрилл внутри волокна имеются многочисленные ядра, митохондрии, называемые саркосомами, специализированная вакуолярная система — саркоплазматический ретикулум, занимающий 13% всего объема волокна, и система поперечных трубочек, так называемая Т-система, объем которой составляет 0,8% от объема волокна (рис. 45). Трубочки Т-системы (диаметр их Достигает 30 нм) ориентированы поперек мышечного волокна на уровне так называемых Z-мембран и имеют связь с поверхностной мембраной. Саркоплазматический ретикулум продольно ориентирован вдоль миофибрилл и на уровне Z-мембран образует утолщения — терминальные кристы, которые вместе с Т-системой образуют так называемые триады. Пространство между структурами волокна заполнено жидкой саркоплазмой.
Толщина миофибрилл составляет 0,5—2 мкм. Сократительные белки в миофибриллах расположены в определенном, регулярном порядке, что и обусловливает поперечную полосатость мышечного волокна — чередующиеся анизотропные А-диски (темные в проходящем свете и светлые в поляризованном) и изотропные I-диски (светлые в проходящем и темные в поляризованном свете). Эта повторяющаяся единица, называемая саркомером, и определяется обычно как расстояние между Z-мембранами. В покоящейся мышце длина саркомера составляет 2,5 мкм.
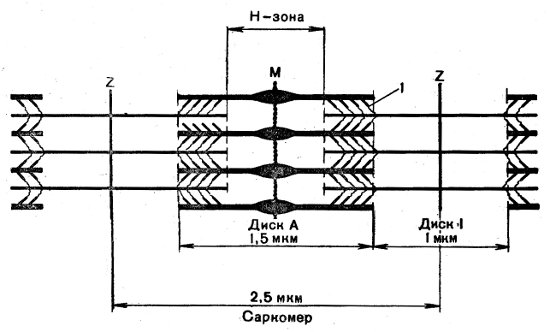
Рис. 46. Схема строения миофибриллы: 1 — поперечные мостики, М — М-мембрана, Z — Z-мембрана
Благодаря рентгеноструктурному анализу и электронно-микроскопическим исследованиям удалось выяснить, что миофибриллы состоят из более тонких волоконец — протофибрилл — двух типов — толстых и тонких, расположенных в определенном порядке: толстые — в А-диске, тонкие — в основном в I-диске, и прикреплены они к Z-мембране (рис. 46). Через центральную область толстых нитей проходит М-мембрана. Зону А-диска, соответствующую только толстым нитям, принято называть Н-зоной. Толстые и тонкие нити соединяются между собой поперечными, достаточно прочными связями, что и обусловливает целостность и прочность миофибрилл. С помощью электронного микроскопа в зоне перекрытия толстых и тонких нитей были обнаружены поперечные мостики. При физиологическом сокращении или растяжении волокна длина саркомера изменяется в основном за счет изменения I-диска, длина А-диска практически не изменяется. Это дало основание думать, что происходит скольжение толстых и тонких нитей друг относительно друга, тонкие нити вдвигаются между толстыми, при этом уменьшается, а затем исчезает Н-зона и Z-мембраны сближаются (рис. 47).
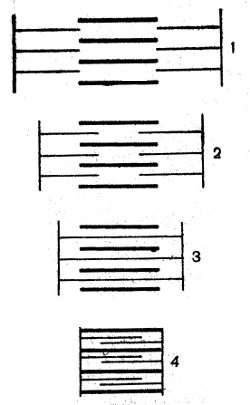
Рис. 47. Расположение толстых и тонких протофибрилл при разной длине саркомера (Huxley, Hanson, 1960): 1 — при растяжении; 2 — в состоянии покоя; 3 и 4 — при сокращении
Толстые протофибриллы (толщиной 10 нм, длиной 1,5 мкм) построены из фибриллярного белка миозина, молекулы которого асимметричны и представляют собой двухцепочную структуру, заканчивающуюся двумя глобулярными головками (рис. 48). Длина молекулы достигает 180 нм, а толщина — 2,5 нм. Молекулы миозина располагаются в толстых нитях таким образом, что головки сосредоточены к периферии анизотропного диска, они-то и образуют так называемые поперечные мостики. Каждая миозиновая нить имеет 210 — 230 таких мостиков. В середине анизотропного диска в районе Н-зоны участки миозиновых волокон гладкие, без мостиков; в этом участке миозиновые нити утолщаются до 14 нм. Проходящая через середину миозиновых нитей мембрана М представляет сетевидную структуру, связывающую между собой толстые протофибриллы. Мостики (головки) имеют очень сложное строение, состоят они из нескольких субфрагментов и обладают ферментативной АТФ-азной активностью и способностью связывать актин.
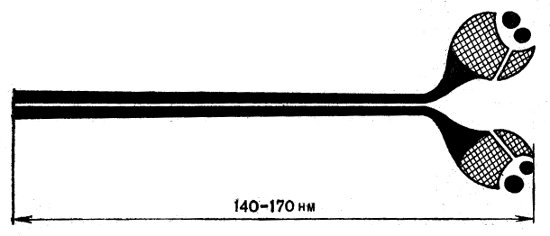
Рис. 48. Схема строения молекулы миозина
Тонкие протофибриллы (диаметром 6 нм) построены из белка актина в форме двух спирально закрученных полипептидных цепочек, состоящих из глобулярных субъединиц. Предполагают, что по длине актиновой нити расположены белки тропомиозин (длиной 40 нм) и тропонин (рис. 49), которые, по-видимому, и регулируют активность актина.
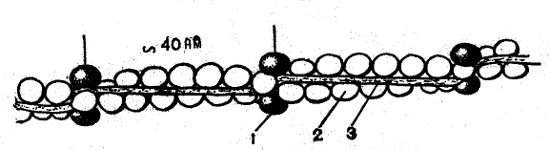
Рис. 49. Схема строения тонкой протофибриллы: 1 — тропонин; 2 — тропомиозин; 3 — актин
Таким образом, актиновые и миозиновые нити в миофибрилле пространственно разделены, их взаимное расположение схематически представлено на поперечном срезе миофибрилл (рис. 50). Толстые миозиновые нити имеют так называемое гексагональное расположение, тонкие актиновые нити находятся на равном расстоянии от трех ближайших миозиновых, и каждая миозиновая нить окружена шестью актиновыми. При таком расположении соотношение миозиновых и актиновых нитей равно 1 : 2. Подобная картина имеет место у всех позвоночных. У насекомых и у краба расположение иное (рис. 50): актиновые нити находятся между двумя соседними миозиновыми и соотношение между миозиновыми и актиновыми нитями у них выражается как 1 : 3. Миозиновые нити насекомых и краба толще (14 нм), чем у позвоночных, а миофибриллы их снабжены большим количеством трубочек саркоплазматической сети.
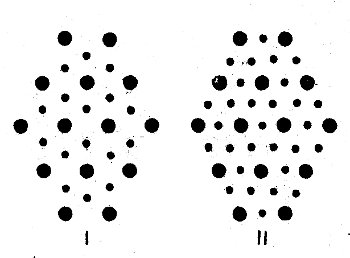
Рис. 50. Схема поперечного сечения миофибриллы скелетного волокна позвоночных (I) и насекомых (II)
Функционирование поперечнополосатого мышечного волокна представляется в настоящее время следующим образом. Нервный импульс, достигнув нервно-мышечного синапса, вызывает выделение ацетилхолина, а затем возникает потенциал действия, распространяющийся по поверхности плазматической мембраны и от нее внутрь мышечного волокна по мембранам Т-системы. Потенциал действия оказывает влияние на мембрану саркоплазматического ретикулума и деполяризует ее. В результате этого ионы Ca2+, заключенные в терминальных цистернах, выходят из саркоплазматического ретикулума в пространство, окружающее фибриллы. Свободные ионы кальция связываются с чувствительным к ним белком тропонином, что изменяет конформацию этого белка и снимает его тормозящее влияние на взаимодействие актина и миозина (в отсутствие свободных ионов кальция тропонин тормозит эту реакцию). Свободные ионы кальция стимулируют также АТФ-азную активность миозина. В результате взаимодействия актина и миозина с участием АТФ происходит сокращение миофибрилл. Каким образом потенциальная химическая энергия АТФ превращается в механическую работу, до сих пор остается неясным. Когда влияние импульса на ретикулум заканчивается, ретикулум восстанавливает способность аккумулировать ионы кальция (он связывает ионы кальция сильнее, чем контрактильные белки) и концентрация свободного кальция падает. В результате этого прекращается взаимодействие нитей и наступает расслабление.
Молекулярный механизм сокращения миофибрилл поперечнополосатого мышечного волокна еще не полностью расшифрован. Имеющиеся данные лучше всего согласуются с гипотезой скольжения нитей (Хаксли, 1965). Согласно ей, взаимодействие актина и миозина вызывает движение протофибрилл таким образом, что тонкие актиновые протофибриллы втягиваются между толстыми миозиновыми и длина саркомера уменьшается. Сами протофибриллы при этом не изменяют своей длины, а только скользят относительно друг друга благодаря работе поперечных мостиков, вступающих во временную связь с актиновыми протофибриллами и двигающими их. Так что движение нитей связано с циклически повторяющимися изменениями конформации и положения поперечных мостиков.
Наряду с этим существуют гипотезы, согласно которым при сокращении изменяется конформация не только мостиков, но и самих протофибрилл. Эти представления подтверждаются также рядом фактов. Весьма вероятно, что имеет место не только скольжение нитей относительно друг друга, но и сокращение самих протофибрилл.
Механизм сокращения гладких мышц еще менее ясен, так как неизвестна их тонкая структура. Хотя они и имеют тонкие и толстые протофибриллы, но поперечных мостиков в них пока не обнаружено. Два вида протофибрилл существует также у большинства двигательных мышц беспозвоночных. Однако точное соотношение между тонкими и толстыми нитями не установлено (оно меняется при сокращении). Известно, что в мышцах моллюсков и пиявок тонких филаментов приблизительно в 5 раз больше, чем толстых. Каждая миозиновая нить должна проталкивать 6 актиновых нитей.
Много ценной информации о работе мышечных клеток было получено на мышечных сократительных моделях — глицеринизированных мышечных волокнах и пленочных актомиозиновых нитях, которые сокращаются и развивают направление подобно живым клеткам, при действии 2—3 мМ АТФ в присутствии ионов магния, Ни миозин, ни актин сами по себе, будучи выделенными из мышцы, не сокращаются при действии АТФ. Способен к сокращению только комплекс актина и миозина — актомиозин. При концентрациях солей, которые имеют место в мышечном волокне, актин и миозин спонтанно ассоциируют, образуя хорошие сократительные модели, что говорит о способности сократительных белков к самоорганизации.
В настоящее время очевидно, что любое движение клеток или их частей обеспечивается сократительными белками, являющимися механохимическими системами, способными химическую энергию АТФ превращать в механическую. В клетках с разной формой движения сократительные белки по-разному организованы. Надмолекулярная организация сократительных белков обусловливает различные типы и способы клеточного движения.
Сократительные белки выделены не только из мышечных клеток, но и из самых разнообразных немышечных клеток — нервных (белок нейростенин), фибробластов, яйцеклеток (овомиозин), тромбоцитов, лейкоцитов, эпителиальных клеток, из митотического веретена клеток позвоночных и насекомых. Актиноподобные белки, выделенные из разных клеток, по своему строению и свойствам оказались сходными друг с другом и с мышечным актином. Миозиноподобные белки гораздо более разнообразны, но все они обладают АТФ-азной активностью и способны взаимодействовать с актином.
По ферментативным свойствам сократительные белки немышечных клеток напоминают белки гладких мышц, их АТФ-азная активность ниже, чем актомиозина скелетных мышц. И количество сократительных белков в немышечных клетках гораздо меньше чем в мышечных. Так, сократительного белка нейростенина в нервной клетке содержится всего лишь 1—2% от общего количества белков, в скелетной же мышце актомиозин составляет 60-80%.
Сократительные белки способны к самоорганизации, к самосборке. Об этом говорят самопроизвольное образование актиновых нитей и актомиозинового комплекса и спонтанная «полимеризация» белковых частиц вируса табачной мозаики. Сократительные белки образуют различные надмолекулярные сократительные структуры, наиболее известными являются сократимые микрофиламенты (микронити) и микротрубочки, обнаруживаемые в цитоплазме самых различных клеток. С функционированием этих структур связывают протоплазменный тип движения (циклоз, амебоидное движение), который, по-видимому, эволюционно является наиболее древним. Правда, помимо сократительной функции, микротрубочкам, свободно рассеянным по цитоплазме, приписывают также роль своеобразного цитоскелета, так что окончательно их функцию нельзя считать установленной, но микротрубочки могут образовывать также различные более сложные сократительные структуры, такие, как двигательный аппарат ресничек и фибриллы или нити митотического веретена. (Изолированные митотические веретена обладают АТФ-азной активностью.) Посредством укорочения хромосомных нитей (прикрепленных к хромосомам) и удлинения непрерывных нитей (тянущихся от одного полюса деления клетки до другого) обеспечивается расхождение хромосом при делении клетки. Скорость движения отдельных хроматид вследствие сокращения хромосомных нитей достигает нескольких микрометров в секунду. Каждая нить (фибрилла) митотического веретена состоит из пучка стандартных микротрубочек, между которыми обнаружены тонкие поперечные мостики.
Митотическое веретено и его фибриллы являются временной структурой в клетке. Веретено появляется только в период деления клетки и исчезает, когда отпадает в нем необходимость. Еще до начала деления в клетке накапливается большой запас белков, необходимых для формирования веретена и его тянущих нитей.
Каков механизм укорочения и удлинения нитей, пока неизвестно. Некоторые авторы считают, что он подобен сборке и разборке молекулярных субъединиц, когда удаление части субъединиц ведет к сокращению нити, а включение новых субъединиц удлиняет нить, подобно тому как это известно для вирусов. Наличие поперечных мостиков дает право думать и о механизме скольжения фибрилл относительно друг друга.
Механизм скольжения привлекается некоторыми авторами и для объяснения движения ресничек и жгутиков, сократительная система которых также построена из микротрубочек, но, в отличие от фибрилл митотического веретена, она длительно функционирует и является стабильной.
Поперечнополосатое мышечное волокно можно рассматривать как систему с самым высоким уровнем организации сократительных элементов. Мышечные волокна синтезируют очень большое количество сократительных белков и содержат много АТФ и креатинфосфата, которые необходимы для их функционирования. По мере изнашивания сократительные белки мышечных волокон обновляются. Так, продолжительность жизни микрофибрилл у кролика составляет около 30 суток (цитоплазматические белки существуют от 2 до 5 суток). Физические нагрузки усиливают синтетические процессы в мышечных клетках и вызывают рабочую гипертрофию мышц.
Имеющиеся экспериментальные Данные говорят о том, что при сокращении поперечнополосатых волокон происходит скольжение толстых и тонких протофибрилл относительно друг друга за счет работы поперечных мостиков, но наряду с этим возможно также изменение длины самих протофибрилл.
Все ли формы движения определяются взаимодействием двух видов белка и совершаются по принципу скольжения, в настоящее время еще неясно. Очевидно лишь, что для всех форм движения общий принцип является единым и основывается он на взаимодействии сократительного белка с АТФ, но реализуется он в каждом конкретном случае, вероятно, по-разному: либо как скольжение протофибрилл относительно друг друга, либо как сокращение самих протофибрилл вследствие изменения конформации (например, спирализации), или в результате удаления отдельных субъединиц.
