Методы изучения клеточной проницаемости
Осмотический метод. Этот метод основан на том факте, что клетки ведут себя как осмометры, т.е. их объем (V) изменяется обратно пропорционально изменению осмотического давления среды (П):
V · П = const.
Однако в это уравнение надо внести поправку (b) на осмотически неактивный объем клетки (сухой остаток и осмотически неактивную воду):
П (V — b) = const.
При помещении клетки в гипертонический раствор объем клетки уменьшается за счет выхода воды до тех пор, пока осмотическое давление внутри клетки не сравняется с осмотическим давлением среды. Если молекулы растворенного вещества не проникают в клетку, то уменьшенный объем клетки сохраняется без изменения и далее (рис. 17, о). Если молекулы растворенного вещества проникают в клетку, но с меньшей скоростью, чем молекулы воды, то сначала произойдет уменьшение объема клетки, затем по мере проникновения молекул из внешнего раствора в клетку объем ее будет увеличиваться, пока не достигнет исходной величины (рис. 17, б); осмотическое давление внутри клетки и в этом случае становится равным наружному осмотическому давлению. По скорости восстановления объема клетки судят о быстроте проникновения в нее растворенного вещества. Если молекулы внешнего раствора проникают через клеточную мембрану с такой же скоростью, Как и молекулы воды, то изменения объема клетки не произойдет (рис. 17, в).
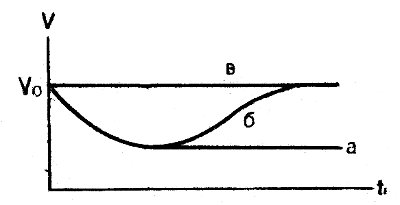
Рис. 17. Изменение клетки в гипертонических растворах веществ: а — не проникающих в клетку; б— проникающих хуже, чем вода; в — проникающих с такой же скоростью, как и вода. По оси абсцисс — время от начала помещения клетки в раствор; по оси ординат — объем клетки
Химические методы. Органы, кусочки тканей или клеточные суспензии помещают в раствор вещества, проницаемость которого исследуется, и через определенные сроки путем химического анализа определяют количество вещества либо в ткани (по прибыли), либо в растворе (по убыли). Если исследование проводится на кусочке ткани, необходимо учитывать межклеточное пространство.
Для изучения содержимого отдельных клеток (и даже их частей) разработаны микрометоды (необходимо 10—0,01 мг вещества) и даже ультрамикрометоды (менее 0,01 мг вещества). Первые получили широкое распространение, вторые ввиду трудоемкости и необходимости сложного специального оборудования применяются в небольшом числе лабораторий.
Изотопные методы. Эти методы основаны на том факте, что молекулы вещества, содержащие радиоактивный изотоп, по своим физико-химическим и химическим свойствам не отличаются от молекул, не содержащих этих изотопов. Они вступают в химические реакции и участвуют во всех физиологических процессах наравне со всеми другими молекулами этого вещества, но их присутствие в клетке и в окружающей среде легко может быть обнаружено путем измерения интенсивности их радиоактивности.
Часто скорость поступления вещества в клетки характеризуется изменением во времени коэффициента распределения Q. Величину коэффициента Q чаще всего определяют с помощью радиоактивности меченых радиоактивными изотопами веществ:
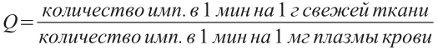
где имп. — число распадов радиоактивного вещества, которое регистрируется счетчиком Гейгера.
Так как количество импульсов в единицу времени и в тканях и в окружающей жидкости прямо пропорционально концентрации меченого вещества в них, то концентрация исследуемого вещества в. любой ткани или органе легко определяется по уравнению:
Cор = Q · Cпл,
где Cор — концентрация вещества в органе и Cпл — в плазме.
Концентрацию вещества в клетках органа определяют по формуле:
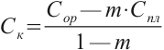
а концентрацию вещества во внутриклеточной воде находят по уравнению:
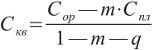
В этих формулах m — величина межклеточных пространств в долях от навески органа и q — масса сухой пробы.
Поступление вещества в клетки определяется и по убыли его из среды. Расчет концентрации вещества в воде клеток ведется в этом случае по формуле:
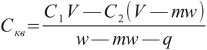
где C1 — концентрация вещества в среде до эксперимента;
С2 — концентрация его после пребывания в растворе органа или ткани;
V — объем окружающего раствора;
w — масса пробы (ткани);
q и m— как указано выше.
Колориметрические методы используются при изучении проницаемости клеток для красителей. При работе с окрашенными органами или кусочками ткани связанный ими краситель экстрагируют обычно подкисленным спиртом и по интенсивности окраски полученных вытяжек судят о количестве сорбированного тканью красителя. При работе на одиночных клетках (мышечные, нервные волокна) используют цитофотометрические установки.
В настоящее время изучается не только проницаемость целой клетки, но и проницаемость ядер и клеточных органелл. Это стало возможным благодаря разработке методов получения изолированных клеточных структур путем дифференциального центрифугирования гомогенатов ткани.
