Аллотропия
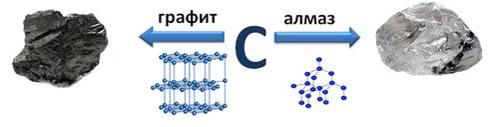
Аллотропия углерода
Аллотропия (термин введен Я. Берцелиусом в 1841 г.) — существование химического элемента в двух или более различных формах, имеющих различную кристаллическую структуру и/или физические свойства. Аллотропы могут различаться по плотности, температуре плавления, молярному объему, цвету и другим физическим свойствам. В одних случаях имеется обратимый, в других — необратимый переход одного аллотропа в другой. Ниже приведены примеры аллотропии.
Углерод: чаоит, графит и лонсдейлит (гексагональная); алмаз (кубическая).
Сера: самородная, или α-сера (ромбическая); γ-сера, или розицкит (моноклинная).
Фосфор: белый/желтый (две формы: кубическая и ромбическая), фиолетовый и черный (всего, таким образом, четыре аллотропа с различными свойствами); красный фосфор представляет собой смесь.
Олово: белое (тетрагональная), серое (кубическая).
Железо: α-железо, или камасит (кубическая объемно центрированная решетка, магнитно); γ-железо, или тэнит (кубическая гранецентрированная решетка, стабильно только при температурах выше 1400 °С).
Кислород: кислород O2 (плотность 1,429 г/л); озон OO3 (плотность 2,144 г/л).
