Твердое (кристаллическое) состояние вещества
1. Кристаллические системы
Кристаллом называется твердое тело, имеющее правильную геометрическую форму. Геометрические формы, наблюдаемые в кристаллах, делят на 6 кристаллических систем (сингоний): кубическую, тетрагональную, ромбическую, гексагональную, моноклинную, триклинную.
Кубическая система характеризуется существованием трех осей, взаимно перпендикулярных и равных между собой.
Примерами геометрических форм кубической системы могут служить: куб (гексаэдр), октаэдр и тетраэдр (рис. 1):
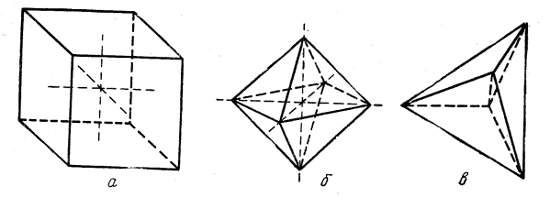
Рис. 1. Основные фигуры симметрии: а — куб, б — октаэдр, в — тетраэдр
Тетрагональная система. Все три оси перпендикулярны между собой, третья короче или длиннее остальных.
Примеры форм тетрагональной системы — тетрагональная бипирамида (рис. 2, а) и тетрагональная призма (рис. 2, б).
Ромбическая система. Все три оси перпендикулярны, но не равны между собой.
Примеры форм ромбической сингонии — ромбическая бипирамида (рис. 2, в) и ромбическая призма (рис. 2, г).
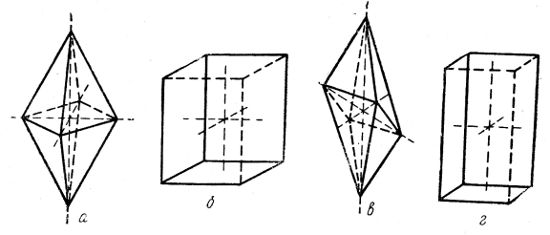
Рис. 2. Многогранники: а — октаэдр с квадратным основанием; б — квадратная призма; в — ромбическая пирамида; г — ромбическая призма
Гексагональная система характеризуется присутствием четырех осей. Главная ось перпендикулярна к трем остальным, эти последние равны между собой и образуют друг с другом углы в 60°; главная ось может быть длиннее или короче остальных.
Примерами форм гексагональной системы могут служить гексагональная бипирамида (рис. 3, а), ромбоэдр (рис. 3, б) и гексагональная призма (рис. 3, в).
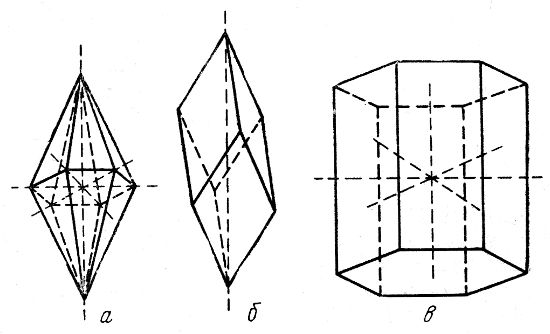
Рис. 3. Многогранники: а — гексагональная пирамида; б — ромбоэдр; в — гексагональная призма
Моноклинная система характеризуется присутствием трех осей; две оси взаимно перпендикулярны, третья — перпендикулярна к одной из них, но наклонна к плоскости первых двух.
Примеры моноклинной системы; моноклиноэдрическая пирамида (рис. 4, а) и моноклиноэдрическая призма (рис. 4, б).
Триклинная система характеризуется тремя осями; все три оси образуют разные углы между собой и имеют различную длину.
Примеры триклинной системы: триклиноэдрическая пирамида (рис. 4, в) и триклиноэдрическая призма (рис. 4, г).
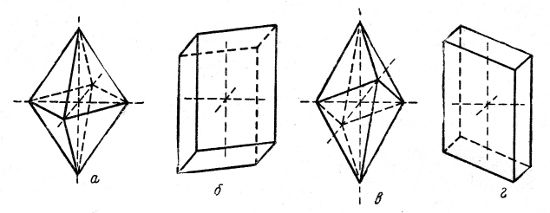
Рис. 4. Многогранники: а — моноклиноэдрическая пирамида; б — моноклиноэдрическая призма; в — триклиноэдрическая пирамида; г — триклиноэдрическая призма
2. Кристаллические решетки
Основанием для деления кристаллов на системы сначала служило положение осей кристаллов, а затем число плоскостей симметрии. Плоскостью симметрии называют плоскость, которая делит кристалл на две одинаковые части.
Зонке (1879 г.), Чермак, Шёнфлис, Федоров (1891 г.) и др. показали геометрически, что все кристаллические формы можно представить как результат распределения точек (мельчайших вещественных частичек) в пространстве по законам симметрии; получающиеся конфигурации они назвали кристаллическими решетками. Распределяя согласно элементам симметрии точки в пространстве, они получили 230 комбинаций, 230 кристаллических решеток, которые соответствуют всем встречающимся в природе кристаллическим формам.
До 1912 г., однако, это было только хорошо разработанной гипотезой; прямых доказательств существования таких кристаллических решеток не было.
В 1912 г. немецкий ученый Лауэ показал, что кристалл относится к пучку рентгеновских лучей, как чрезвычайно тонкая дифракционная решетка, период которой колеблется в пределах нескольких ангстрем. Лучи Рентгена, отражаясь от элементов такой кристаллической решетки, интерферируют и, в зависимости от постановки опыта, дают на фотографической пластинке пятна (метод Лауэ), линии (метод Брэгга) или кривые (метод Дебая — Шерера). По тем фигурам, которые получаются на фотографической пленке и которые представляют собой проекцию действительных элементов кристаллической решетки на вертикальную плоскость фотографической пластинки (пленки), воссоздают действительную кристаллическую решетку, а следовательно, и форму кристалла.
На рис. 5, а показано изображение, которое получается на фотографической пластинке при пропускании лучей Рентгена (λ = 0,1—10 А) через кристалл. Лучи направлены перпендикулярно к плоскости куба кристалла ZnS.
На рис. 5, б эта рентгенограмма расшифрована, т. е. показано действительное распределение ионов Zn и S в пространстве.
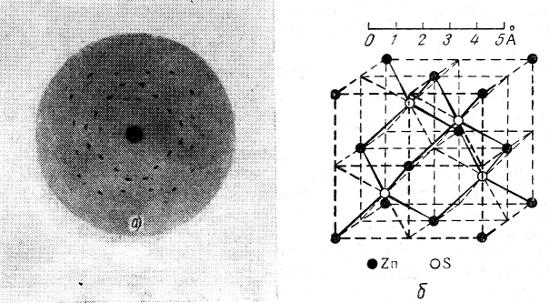
Рис. 5. Кристаллическая решетка цинковой обманки: а — лауэграмма; б — решетка
На рисунке показан небольшой участок, вырезанный из кристалла. Нужно представить справа, слева, вверху, внизу, спереди и сзади такую же структуру. Черные шары обозначают ионы цинка, белые — ионы серы.
Исследование кристаллов лучами Рентгена не только дало прямые доказательства существования атомов, ионов и их расположения в пространстве, не только подтвердило те предположения и выводы, которые были сделаны косвенным путем, но предоставило богатый материал для суждения о строении молекул.
В дальнейшем, при описании различных кристаллизующихся соединений, мы будем широко пользоваться материалом, накопленным рентгеноскопией, здесь же мы ознакомимся лишь с общими результатами.
Кристаллические решетки, как выяснилось, делятся на следующие группы: атомные, ионные, молекулярные и металлические.
Атомные решетки. Каждое узловое место в атомной решетке занято нейтральным атомом. Как пример приведем кристаллическую решетку аргона (рис. 6).
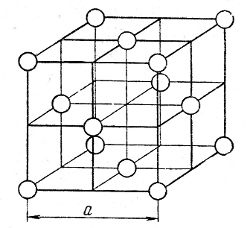
Рис. 6. Кристаллическая решетка аргона
Ионные решетки. Каждое узловое место в ионной решетке занято ионом. Для примера приведем кристаллические решетки Na+Cl—, Cs+I— и Са2+F2—.
Кристаллическая решетка Na+Cl— (рис. 7) типична для бинарных электролитов, состоит из двух центрированных в гранях решеток, вдвинутых одна в другую на 1/2 длины ребра куба. Одна решетка — катиона Na+, другая такая же — аниона Cl—,
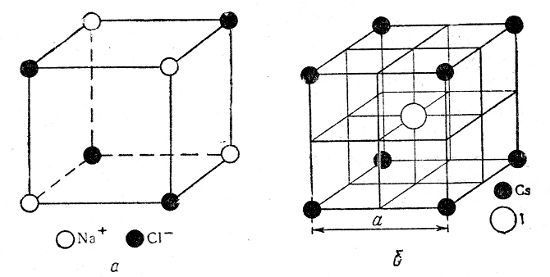
Рис. 7. Кристаллические решетки: а — NaCl, б — CsI
Кристаллическая решетка Cs+I— (рис. 7) представляет собой сочетание двух простых кубических решеток: решетки иона Cs+ и решетки иона I—, вдвинутых одна в другую так, что в центре куба находится ион иода, а в углах — ионы Cs+. Эта решетка центрирована в пространстве с той лишь разницей, что в центре куба находится анион, а в углах — катионы.
Кристаллическая решетка Ca2+F2— типична для многих тройных электролитов (рис. 8). Здесь ионы Ca2+ образуют кристаллическую центрированную в гранях решетку, ионы же F— расположены в срединах 8 маленьких кубов, на которые может быть разложен большой куб.

Рис. 8. Кристаллическая решетка CaF2—
В ионных кристаллических решетках отдельные места могут занимать сложные и комплексные ионы.
Примеры: решетка нитрата натрия Na+NO3— (рис. 9, а) и решетка гексахлороплатината калия K2+[PtCl6]2— (рис. 9, б).
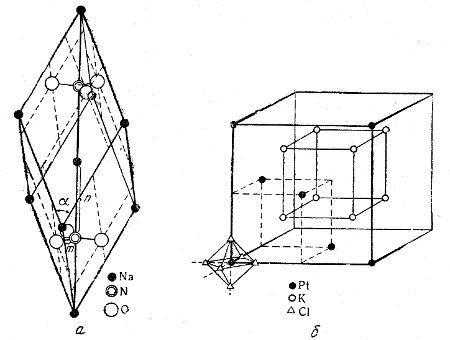
Рис. 9. Кристаллические решетки: а — NaNO3, б — K2[PtCl6]
Здесь отдельные места занимают ионы Na+, K+, NO3—, [PtCl6]2—.
В кристаллической решетке нитрата натрия каждый ион NO3— занимает одно место, причем в центре тетраэдра — атом азота N5+, а в углах — атомы кислорода О; атомы сближены друг с другом и составляют прочную, крепко стянутую группу. Такую же группу представляет собой прочный комплексный ион [PtCl6]2—. Пространственно он построен так: в центре октаэдра — ион Pt4+, а в углах — ионы Cl—. Ионы [PtCl6]2— занимают углы кубической, центрированной в гранях, кристаллической решетки. Ионы К+ составляют куб.
Молекулярные решетки. В молекулярных решетках отдельные места занимают молекулы. Примером молекулярных решеток соединений, которые рассматриваются в неорганической химии, могут служить кристаллические решетки окиси алюминия (рис. 10, а) и двуокиси углерода CO2 (рис. 10, б).
В кристаллической решетке окиси алюминия Аl2O3 углы ромба с длиной ребра α0 = 5,12 А занимают тесно расположенные друг к другу группы атомов, образующие нейтральную молекулу Аl2O3.
В кристаллической центрированной в гранях решетке двуокиси углерода отдельные места занимают нейтральные молекулы CO2, очень сближенные группы из трех атомов С и 2O, сгруппированные так, как это показано на рис. 10, б.
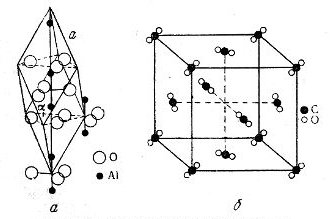
Рис. 10. Кристаллические решетки: a — корунда Аl2O3, б — двуокиси углерода CO2
Металлические решетки. Металлические решетки характеризуются особыми свойствами, отличающими их от других типов кристаллических решеток. В узлах металлических решеток находятся не атомы, а положительные ионы. Внешние электроны атомов металлов свободно мигрируют внутри кристаллической решетки, переходя от одного иона к другому, т. е. ведут себя подобно молекулам газа, почему всю совокупность электронов в кристаллической решетке металлов называют электронным газом. Таким образом, металлическую решетку можно рассматривать как ионную решетку, находящуюся во внутренней «атмосфере» электронного газа из внешних электронов. Такова, например, решетка металлического натрия (рис. 11).
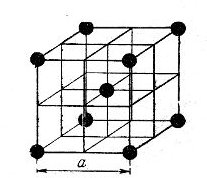
Рис. 11. Решетка металлического натрия
Характерные свойства металлов — электропроводность и теплопроводность, в частности, зависят от передвижения электронов внутри решетки. Под воздействием внешнего электрического поля валентные электроны, число которых у атомов металлов невелико (1, 2 или 3), перемещаются в направлении поля, создавая электрическую проводимость.
3. Силы, связывающие отдельные элементы кристаллической решетки
В ионных кристаллических решетках, очевидно, ионы удерживаются силами электростатического притяжения аниона к катиону. На рис. 78, а ясно видно, что в кристаллической решетке Na+Cl— каждый ион хлора окружен шестью ионами натрия, находящимися от него на одинаковых расстояниях, равных ab/2 точно так же и каждый ион натрия окружен шестью ионами Cl—.
Число 6 называется координационным числом кристаллической решетки.
В кристаллической решетке йодистого цезия Cs+I— (рис. 7, б) каждый ион иода окружен восемью ионами цезия, находящимися от него на одинаковых расстояниях, и каждый ион цезия окружен восемью ионами иода. Здесь координационное число решетки 8. При расплавлении вещества, например Na+Cl—, кристаллическая решетка разрушается и ионы скользят друг около друга.
Вещество в жидком состоянии проводит электрический ток. При переходе в парообразное состояние ионы стягиваются в нейтральные молекулы, хотя небольшая часть их остается в виде ионов. Однако некоторые вещества, например соединения галогенов со щелочными металлами (Na+Cl—, K+Cl— и др.), и в состоянии пара разделены на ионы.
Ионы обычно рассматриваются как твердые шары, несущие в центре положительный или отрицательный заряд. Сфера действия центрального заряда иона называется кажущимся радиусом иона (Гольдшмидт). Но наблюдаются и деформации ионов.
Что такое деформация ионов? При сближении двух ионов А и В электроны под влиянием заряда соседнего иона сдвигаются с мест и принимают такое положение, при котором центры тяжести положительных и отрицательных зарядов не совпадают; получается так называемый индуцированный диполь (l1, l2), т.е. атом, в одной половине заряженный положительно, в другой — отрицательно.
На рис. 12 показан сдвиг электронов под влиянием заряда соседнего иона с образованием индуцированных диполей с деформированной электронной оболочкой (Фаянс). При сближении ионов каждый из них является диполем. Это, конечно, оказывает влияние на группировку таких ионов в кристаллической решетке. При дальнейшем сближении деформированных ионов и далеко идущей их взаимной поляризации получается неполярная (атомная) молекула.
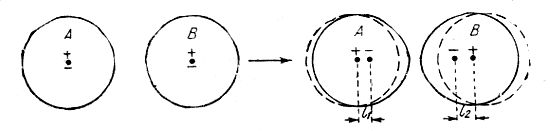
Рис. 12. Деформация ионов
В кристаллах, в зависимости от типа молекул, могут проявляться следующие типы связи: ионная, ковалентная, ван-дер-ваальсовская и металлическая. Если для ионных кристаллов проявляются в основном электростатические силы, то в других типах кристаллов выделить тот или иной вид связи в «чистом виде» вряд ли возможно, так как, вследствие поляризации, возможно возникновение индуцированных диполей: помимо ван-дер-ваальсовских сил проявляются и электростатические силы.
Если молекулы образованы за счет ковалентных связей и не обладают ни постоянным, ни индуцированным дипольным моментом, то в кристаллической решетке действуют только ван-дер-ваальсовские силы. В этом случае вещества обладают низкими температурами плавления и кипения: при нормальных условиях они газообразны или являются жидкостями и, редко, твердыми веществами.
4. Причины образования той или другой кристаллической решетки
Причины образования той или иной кристаллической решетки нельзя считать полностью установленными. Однако накопившийся материал позволил Гольдшмидту сделать ряд следующих выводов:
а) Ионные кристаллические решетки двойных соединений резко отличаются от решеток тройных соединений. Следовательно, число ионов, из которых образовано соединение, имеет важное значение.
б) Тип кристаллических решеток определяется величиной кажущихся радиусов ионов. Гольдшмидт для тройных электролитов, фторидов и двуокисей металлов установил следующее правило:
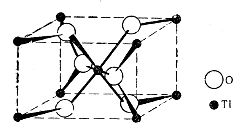
Рис 13. Решетка рутила
Если отношение радиуса катиона rкат к радиусу аниона rан больше, чем 0,7, то образуется решетка типа фтористого кальция (рис. 8); если rкат/rан < 0,7, то получается решетка так называемого типа рутила (рис. 13); если отношение радиусов становится еще меньшим, то кристаллическая решетка принимает новую форму (например, для SiO2 rкат/rан = 0,3) и, наконец, при соотношении rкат/rан < 0,3 переходит в молекулярную (например, для CO2, где rкат/rан < 0,22).
| Влияние радиуса ионов тройных соединений на тип кристаллической решетки | ||||||||||
| Соединения | Тип решетки CaF2 | Тип решетки рутила TiO2 | ||||||||
| Фториды | BaF2 | PbF2 | SrF2 | HgF2 | CdF2 | MnF2 | ZnF2 | CoF2 | FeF2 | NiF2 |
| rкат/rан | 1,08 | 0,99 | 0,95 | 0,84 | 0,77 | 0,68 | 0,62 | 0,62 | 0,62 | 0,59 |
| Двуокиси | ThO2 | UO2 | CeO2 | PrO2 | ZrO2 | TeO2 | PbO2 | SnO2 | NbO2 | WO2 |
| rкат/rан | 0,84 | 0,80 | 0,77 | 0,76 | 0,66 | 0,67 | 0,64 | 0,56 | 0,52 | 0,52 |
| OsO2 | IrO2 | RuO2 | TiO2 | VO2 | MnO2 | |||||
| 0,51 | 0,50 | 0,49 | 0,48 | 0,48 | 0,39 | |||||
в) На типе образующейся решетки сказывается и деформация ионов. Так, согласно предыдущему правилу CdI2 должен был бы иметь кристаллическую решетку типа рутила, так как rCd2+ /rI— = 0,47. Но так как I— сильно деформирован, то образуется новая решетка.
г) Большое значение при образовании решетки имеет также температура.
Влиянием температуры на тип кристаллической решетки объясняется явление полиморфизма, т. е. существование для одного и того же вещества нескольких различных кристаллических форм.
Например, кристаллическая решетка олова при температурах ниже 13,2°C подобна кристаллической решетке алмаза (серое, или α-олово). Выше 13,2°C оно образует кристаллы тетрагональной системы (обыкновенное, или β-олово). При температуре 13,2°C, которая называется температурой перехода, обе модификации устойчивы, т. е. могут существовать рядом как угодно долго.
Процесс перехода α-модификации в β-модификацию и обратно протекает при невысоких температурах чрезвычайно медленно. Выше 161°C тетрагональная кристаллическая решетка переходит в ромбическую (γ-олово).
